Kalor merupakan bentuk energi yang pindah karena adanya perbedaan suhu. Secara alamiah, kalor berpindah dari benda bersuhu tinggi ke benda bersuhu rendah. Sebelum abad ke – 17, orang beranggapan bahwa kalor merupakan zat yang pindah dari benda bersuhu tinggi ke benda yang bersuhu rendah. Jika kalor merupakan zat, tentu mempunyai masa. Ternyata benda yang suhunya naik, massanya tidak berubah, jadi kalor bukan zat.
Satuan kalor :
- Sistem internasional ( SI ) ; joule ( J )
- Sistem lain ; kalori ( kal ) dimana 1 kalori = 4,2 ; BTU dimana 1 BTU = 252 kalori
Lakukan percobaan-percobaan sebagai berikut :
Percobaan 1
- Masukkan air dengan volume 200 mL dalam gelas kimia.
- Panaskan air tersebut dengan pembakar spiritus, dan catat perubahan suhunya, seperti pada tabel pengamatan.
- Sama seperti percobaan 1, gantilah volume air dengan 100 mL
- Sama seperti percobaan 1, gantilah air dengan minyak bervolume 200 ml
- Semakin lama dipanaskan (semakin banyak kalor diberikan ) suhu air semakin naik tinggi.
- Dengan pemberian kalor yang sama, ternyata air bervolume 100 mL lebih cepat naik suhunya dari pada air bervolume 200 mL.
- Dengan pemberian kalor yang sama pada volume yang sama, ternyata minyak lebih cepat naik suhunya dari pada air.
1. Perubahan kalor – kalor suatu benda sebanding dengan perubahan suhu benda tersebut:
- penambahan kalor sebanding dengan penambahan suhu.
- Pengurangan kalor sebanding dengan penurunan suhu
Secara matematis dirumuskan sebagai :
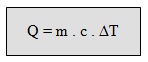

3. Kapasitas kalor
Kapasitas adalah banyaknya kalor yang diperlukan/dilepaskan untuk menaikkan / menurunkan suhu benda sebesar 1 Kelvin / 10 C.
Secara matematis dirumuskan sebagai :
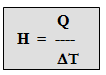
H = kapasitas kalor, satuannya J/K
4. Kalor Dapat Mengubah Wujud Zat
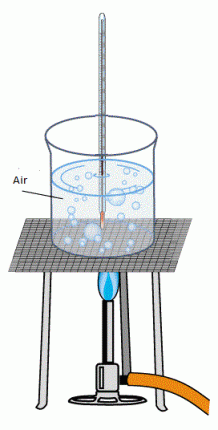
Lakukan percobaan sebagai berikut :
Percobaan 4
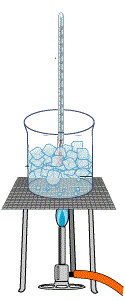
- Masukkan es ke dalam gelas kimia
- Panaskan es dengan pembakar spiritus
- Catat perubahan suhunya setiap dua menit
- Catat suhu pada saat es mencair
- Catat suhu pada saat terjadi penguapan
- Amati perubahan suhu pada saat air mulai mendidih dan sedikit demi sedikit berubah menjadi uap air Jadi, dapat disimpulkan bahwa kalor yang diberikan pada suatu zat
dapat mengubah wujud zat tersebut. Contohnya, pada percobaan 4 di atas,
kalor yang diberikan pada es ( wujud padat ) dapat mengubah wujud es
menjadi air ( wujud cair ), dan air dapat berubah menjadi uap air (
wujud gas ).
Perhatikanlah diagram perubahan wujud zat berikut ini!
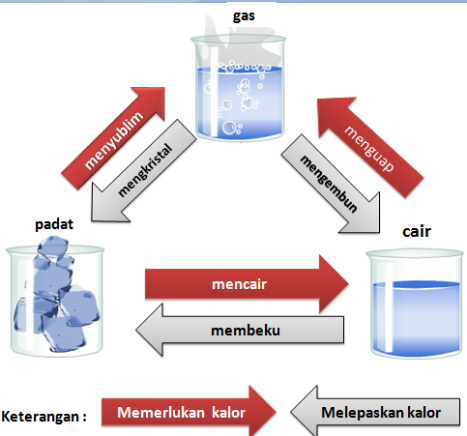
Selama terjadi perubahan wujud ( selama melebur, membeku, menguap, mengembun, menyublim, dan deposisi ) suhu zat tetap. Pada saat itu, seluruh kalor yang diserap atau yang dilepaskan digunakan untuk mengubah wujud benda
5.Menguap, Mendidih, dan Melebur
Pada percobaan 4 di atas, juga diperoleh fakta bahwa menguap dapat terjadi pada sembarang suhu, sedangkan mendidih hanya terjadi pada suhu tertentu ( yaitu pada titik didihnya ).
Pada pengupan gelembung-gelembung uap hanya terjadi pada permukaan saja; sedangkan pada peristiwa mendidih gelembung-gelembung uap terjadi pada seluruh bagian zat cair.
Penguapan dapat dipercepat dengan cara antara lain :
1) memanaskan
2) memperluas permukaan
3) meniupkan udara di atas permukaan
4) mengurangi tekanan udara di atas permukaan
Zat mendidih pada suhu tetap, asalkan tekanannya tetap. Titik didih suatu zat dapat diturunkan, dengan menurunkan tekanannya. Titik didih normal didefinisikan sebagai titik didih di bawah pengaruh tekanan 1 atmosfir.
Jumlah kalor yang diperlukan selama pendidihan / penguapan tergantung pada massa zat dan jenis zat. Secara matematis ditulis.

Seperti pada proses mendidih, pada proses melebur suhu zat tetap asalkan tekanannya tetap. Suhu dimana zat melebur disebut titik lebur. Titik lebur normal didefiniskan sebagai titik lebur di bawah pengaruh tekanan 1 atmosfir.
Jumlah kalor yang diperlukan selama melebur tergantung pada massa zat dan jenis zat. Secara matematis ditulis.

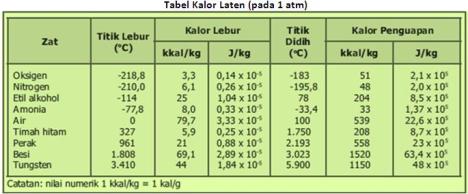
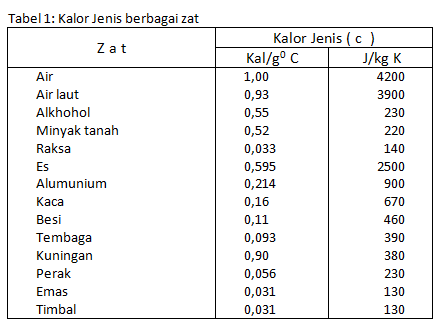
sumber tabel : http://www.ittelkom.ac.id/admisi/elearning/images/EP-6D08.JPG
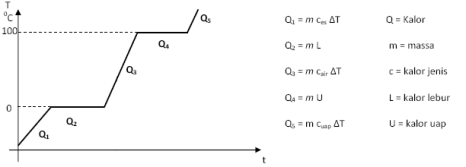
Untuk jelasnya lihat diagram kalor berikut:


Tidak ada komentar:
Posting Komentar